SUSTITUCIÓN
NUCLEOFÍLICA

Una circunstancia problemática de este tipo de reacciones es que dado el inseparable carácter básico de los nucleófilos, la sustitución nucleofílica compite con la eliminación.
Los casos más importantes de sustitución nucleofílica son los que se dan en los haluros de alquilo y en los alcoholes. En ambos casos, el carbono atacado está unido a un heteroátomo (halógeno u oxígeno). Esta circunstancia provoca en él un déficit electrónico (centro electrófilo) que lo hace atractivo para especies de elevada densidad electrónica (nucleófilos). El ataque del nucleófilo al carbono electrófilo del sustrato provoca la salida de un átomo o grupo de átomos (grupo saliente) que estaba unido al carbono.
La sustitución nucleofílica en haluros de alquilo tiene un gran interés sintético ya que con ella se pueden obtener diversos tipos de productos: alcoholes, éteres, nitrilos, ...

Como veremos, una de las grandes diferencias entre haluros de alquilo y alcoholes en la sustitución nucleofílica es que los iones haluro son, en general, buenos grupso salientes, sin embargo, el ion hidroxilo no lo es.
La sustitución nucleofílica puede desarrollarse de acuerdo a dos mecanismos diferentes:
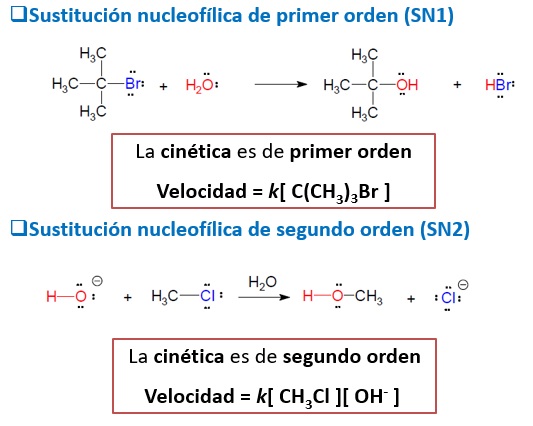
SUSTITUCIÓN NUCLEOFÍLICA DE SEGUNDO ORDEN

Es una reacción concertada, se produce en un solo paso en el que el nucleófilo forma un enlace con el carbono atacado, al mismo iempo que el carbono rompe el enlace con el grupo saliente.
Mecanismo interactivo
En este ejemplo, el ion hidroxilo actúa como nucleófilo, el carbono del cloro metano actúa como electrófilo y el ion cloruro es el grupo saliente.
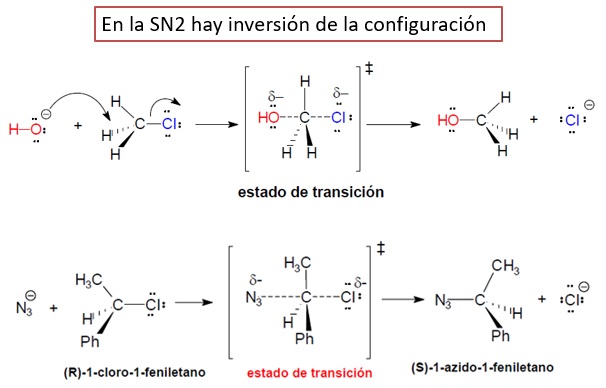
La geometría de esta reacción es específica. Solo ocurrirá cuando el nucleófilo ataque al carbono por la cara opuesta a la que se encuentra el grupo saliente.

ver simulación
El estado de transición es una especie muy inestable con un carbono plano pentaenlazado.


Como en el único paso del mecanismo intervienen los dos reactivos: nucleófilo y sustrato, la velocidad de reacción dependerá de las concentraciones de ambas especies. Esta reacción es, por tanto, de segundo orden.

Sustitución nucleofílica SN2 en el bromuro
de etilo con ion cianuro
Estereoquímica: Como el nucleófilo entra por una cara del sustrato y el grupo saliente sale por la contraria, se produce inversión de la configuración.
SUSTITUCIÓN NUCLEOFÍLICA DE PRIMER ORDEN
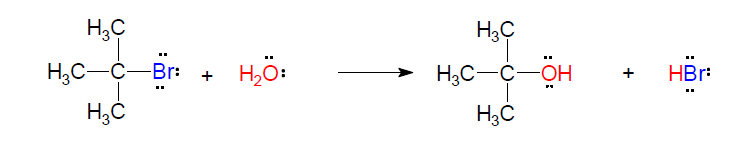
El mecanismo de la SN1 tiene dos etapas. En la primera se forma un carbocatión. Este es el paso lento y controla la velocidad de reacción. Posteriormente, el carbocatión (plano) es atacado por ambas caras por el nucleófilo. Al contrario que en la SN2, el grupo saliente se aleja sin la necesidad de que el nucleófilo ataque al sustrato.

Mecanismo interactivo
En el ejemplo propuesto, el carbocatión formado en la primera etapa (electrófilo poderoso porque no tiene completo el octeto electrónico) es atacado por la molécula de agua (nucleófilo suave pero abundante en el medio) llenando el orbital p vacío con un par de electrones y formando un nuevo enlace. El alcohol protonado obtenido es una especie muy ácida que inmediatamente es desprotonado en un proceso ácido-base por el ion bromuro (actuando como base).
Como en el paso controlante de la velocidad (formación del carbocatión) sólo interviene el sustrato, la velocidad de reacción solo dependerá de su concentración. La concentración del nucleófilo no afecta a la velocidad de reacción.

La curva de energía libre muestra dos máximos locales que corresponden a los estados de transición de las dos reacciones elementales del mecanismo. Entre ellos un valle que corresponde al intermedio de reacción, el carbocatión.
Estereoquímica: Como el carbocatión plano es atacado por ambas caras, se produce una mezcla de isómeros en idéntica proporción, es decir, una mezcla racémica (racemización).


Ejemplo: hidrólisis de (S)-3-cloro-3-metilhexano

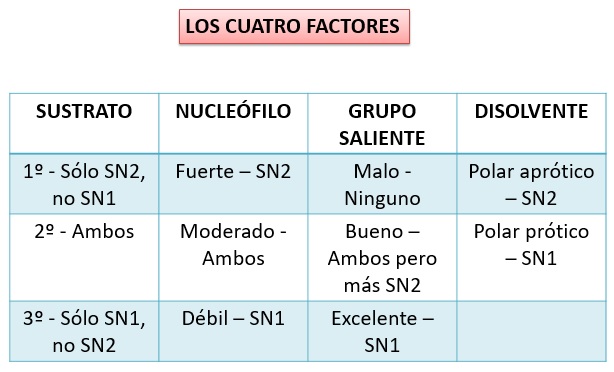
FACTORES QUE AFECTAN AL MECANISMO DE REACCIÓN
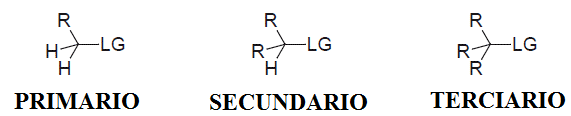
1.- SUSTRATO
El tipo de carbono atacado (primario, secundario o terciario) condiciona la accesibilidad del nucleófilo y, por tanto, el mecanismo de reacción.
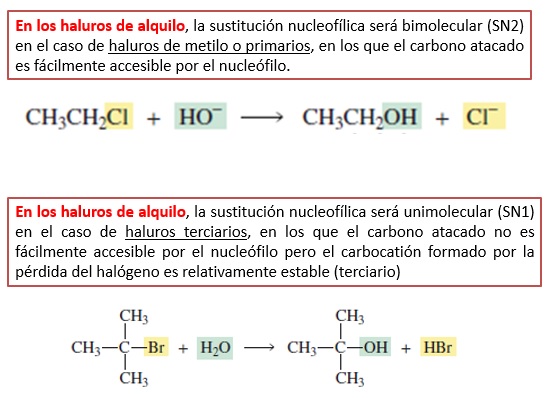
El mecanismo SN2 está favorecido en sustratos primarios. El carbono atacado es muy accesible
El mecanismo SN1 está favorecido en sustratos terciarios. El carbocatión intermedio es muy estable
La velocidad de la sustitución nucleofílica cambia con el tipo de sustrato en cada uno de los mecanismos. En la SN2 la velocidad de reacción se reduce en el sentido 1º > 2º > 3º porque en ese sentido crecen las dificultades del nucleófilo para acceder al carbono atacado. En la SN1, por el contrario, la velocidad de reacción aumenta en ese mismo sentido 1º < 2º < 3º porque el carbocatión formado en el paso lento del proceso es cada vez más estable.


Indicar en cuáles de los siguientes casos está favorecida la SN1, la SN2 o ninguna de ellas.
2.- NUCLEÓFILO
Nucleófilos fuertes favorecen el mecanismo SN2
La fuerza del nucleófilo no afecta al mecanismo SN1
En el paso controlante del mecanismo SN2 el nucleófilo ataca al sustrato. Por tanto, en este caso la fuerza del nucleófilo sí tiene importancia. Un nucleófilo débil (p.e. agua) nunca provocará una sustitución nucleofílica de segundo orden. Cuanto más fuerte sea el nucleófilo más probable es el mecanismo SN2.
Por otra parte, el paso controlante del mecanismo SN1 es la formación del carbocatión sin influencia del nucleófilo. En principio, cualquier nucleófilo podría verse involucrado en un mecanismo SN1 pero como los nucleófilos fuertes favorecen el mecanismo SN2, en la práctica el mecanismo SN1 queda reservado para nucleófilos débiles (tipo agua).
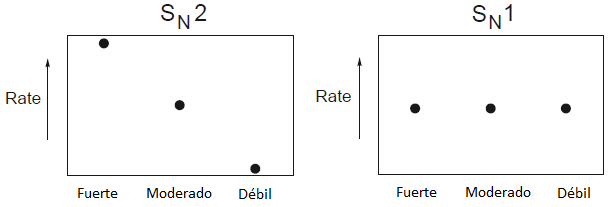
A continuación se clasifican los nucleófilos en débiles, moderados y fuertes. Se consideran débiles los nucleófilos neutros con pares de electrones no compartidos. Moderados a los haluros y a los nucleófilos con carga negativa estabilizada por resonancia. Fuertes a los nucleófilos con carga negativa no estabilizada por resonancia.

Para cada de los siguientes nucleófilos, indicar cuáles favorecerán los mecanismos SN1 , SN2 o presentan dudas.

3.- GRUPO SALIENTE
Los buenos grupos salientes favorecen los dos mecanismos
Los grupos salientes excelentes favorecen el mecanismo SN1
Tanto en el mecanismo SN1 como en el SN2, la ruptura del enlace que une el grupo saliente con el carbono atacado, forma parte del paso controlante de la velocidad. Por ello, cuanto más fácil sea este proceso, mayor será la velocidad tanto en un mecanismo como en el otro. Sin embargo, en el mecanismo SN2 el alejamiento del grupo saliente está impulsado por el ataque del nucleófilo, pero en el SN1 el grupo saliente se desprende espontáneamente. Por ello, la presencia de grupos salientes excelentes favorece el mecanismo SN1.

Los buenos grupos salientes están caracterizados por ser bases débiles. En otro apartado se ha estudiado la fuerza de ácidos y bases. En base a ello, se han clasificado los grupos salientes en tres categorías: excelentes, buenos y malos. Los grupos salientes excelentes son neutros y poseen pares de electrones no compartidos (por ejemplo, agua o amoniaco). Los buenos grupos salientes son los haluros y especies químicas que estabilizan la carga negativa por resonancia (por ejemplo acetato o bencenosulfonato). Los malos grupos salientes serían aquellos que mostraran carga negativa no estabilizada por resonancia (por ejemplo metóxido, hidroxilo o amiduro).
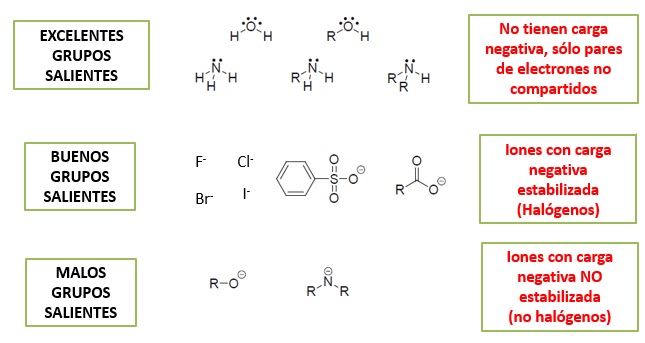
Convertir un mal grupo saliente en un excelente grupo saliente
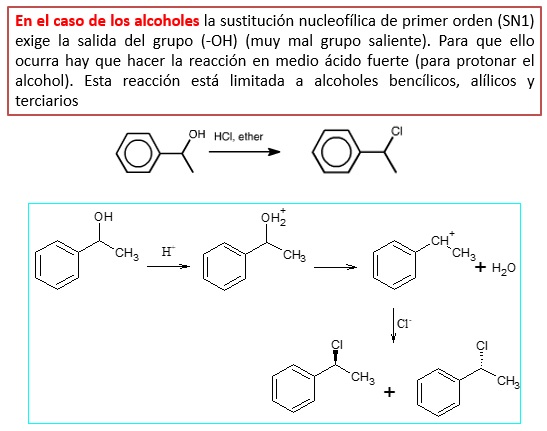
El sustituyente -OH de los alcoholes es un mal grupo saliente. Sin embargo, disponemos de algunas alternativas para facilitar su salida en un proceso de sustitución nucleofílica.
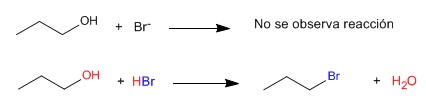
El ion bromuro es incapaz de desplazar el OH de un alcohol, sin embargo, si en lugar de un ion bromuro se utiliza ácido bromhídrico la reacción de sustitución se produce.
Si el alcohol es colocado en medio ácido se produce la protonación del grupo hidroxilo, formándose una molécula de agua que sí es un buen saliente.

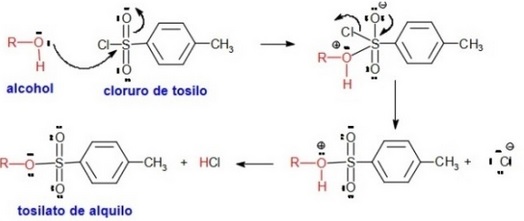
Por otra parte, existen iones como el triflato, el mesilato o el tosilato que son capaces de convertir un mal grupo saliente como es el hidroxilo -OH en un otro que es excelente.

El cloruro de tosilo se obtiene de la reacción entre ácido p-toluensulfónico con ácido clorhídrico

El grupo tosilo (p-toluensulfonilo) posee una estructura con gran resonancia, por ello, al unirse al O del grupo alcohol, forma un grupo saliente en el que la carga negativa está ampliamente deslocalizada.

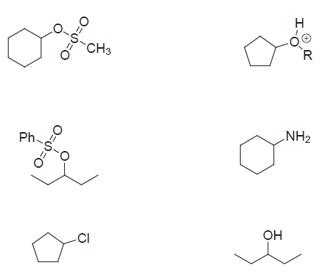
Valore el tipo de grupo saliente en los siguientes sustratos. ¿Cuáles de ellos podrían sufrir SN1 con facilidad en base al grupo saliente?
4.- DISOLVENTE
En otro apartado se han analizado los factores que influyen en la fuerza de los nucleófilos. Entre ellos juega un papel fundamental el disolvente en el que se realiza la reacción de sustitución.
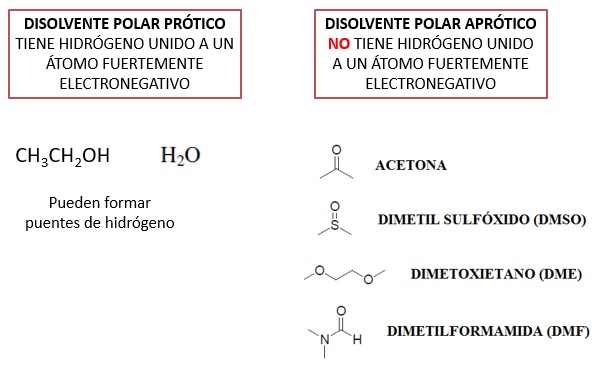
Los disolventes se pueden agrupar en dos grandes tipos: disolventes próticos y apróticos.
Los disolventes próticos tienen átomos de hidrógeno unidos a un átomo fuertemente negativo como el oxígeno. Eso les permite interaccionar intensamente con el nucleófilo afectando a su fuerza. Ejemplos de ellos son el agua o el etanol.
Los disolventes apróticos no tienen átomos de hidrógeno unidos a átomos electronegativos y eso reduce su capacidad de interacción con el nucleófilo. Ejemplos de ellos son la acetona o la dimetilformamida (DMF).
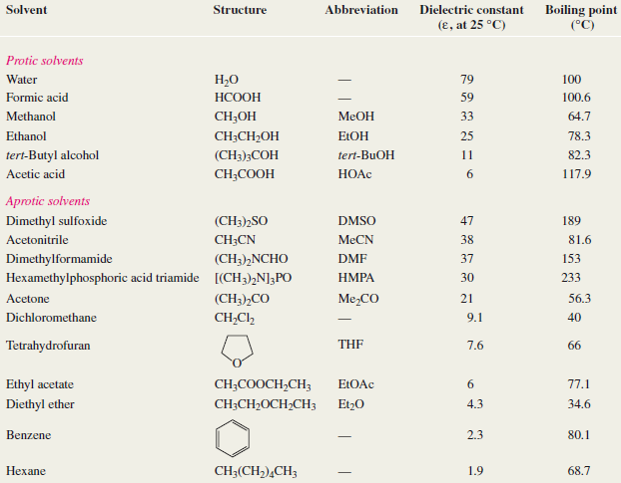
A continuación se presenta una relación de disolventes próticos y apróticos con indicación de su constante dieléctrica.
Los disolventes apróticos favorecen el mecanismo SN2
Los disolventes próticos favorecen el mecanismo SN1

Las moléculas del disolvente prótico rodean el nucleófilo formando fuertes enlaces con él y apantallando su nucleofilia. Eso dificulta el mecanismo SN2, por ello, si queremos favorecerlo habría que utilizar un disolvente que tuviera una interacción suave con el nucleófilo, es decir, un disolvente aprótico.
Por el contrario, la presencia de un disolvente prótico favorece el mecanismo SN1 porque estabiliza el carbocatión formado en el paso lento del proceso. Las moléculas de disolvente prótico solvatan el carbocatión y le permiten existir el tiempo necesario para que el nucleófilo impacte con él.
En el caso de que la reacción de sustitución nucleofílica se realice sobre un sustrato secundario, que el nucleófilo sea moderado y que el grupo saliente sea bueno, la dominancia de un mecanismo u otro dependerá del disolvente utilizado. Por ejemplo, el siguiente proceso será SN2 con DMSO (dimetilsulfóxido) pero tendría una notable fracción de producto SN1 si el disolvente fuera agua.

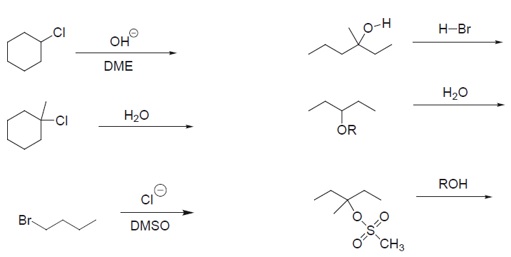
Aplique los cuatro factores para determinar el mecanismo de los siguientes procesos de sustitución nucleofílica. ¿Cuál de ellos no se produciría?.
ESTEREOQUÍMICA DE LA SUSTITUCIÓN NUCLEOFÍLICA

TRANSPOSICIONES EN LOS CARBOCATIONES EN SN1
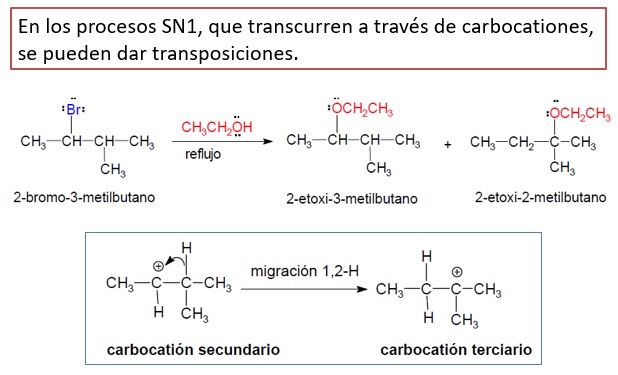
La salida del ion bromuro en la primera etapa del mecanismo produce un carbocatión secundario. Este carbocatión puede sufrir un desplazamiento de hidruro convirtiéndose en un carbocatión terciario más estable. En consecuencia, en el medio existirá dos carbocationes que darán lugar a dos productos distintos.
En las sustituciones que transcurran a través de un mecanismo SN1 siempre hay que contemplar la posibilidad de transposición en los carbocationes.
simulación transposición carbocationes
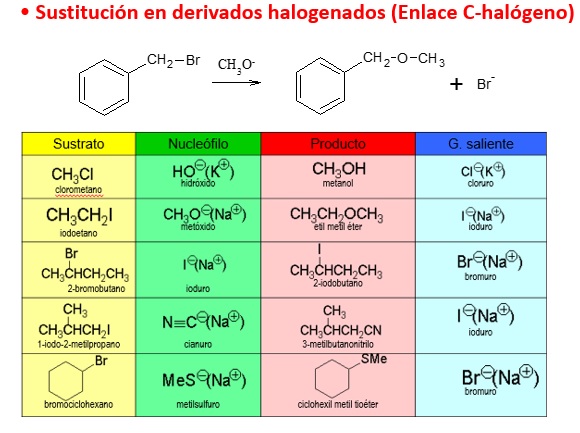
REACCIONES DE SUSTITUCIÓN EN HALUROS DE ALQUILO

La sustitución nucleofílica en haluros de alquilo es una reacción muy versátil y tiene un gran interés sintético ya que eligiendo adecuadamente el nucleófilo, se pueden obtener productos muy diferentes: alcohol, tiol, éter, amina, alquino, nitrilo, ... Por ejemplo, la reacción de un haluro de alquilo con un alquinuro, permite el alargamiento de la cadena carbonada.
REACCIONES DE SUSTITUCIÓN EN ALCOHOLES
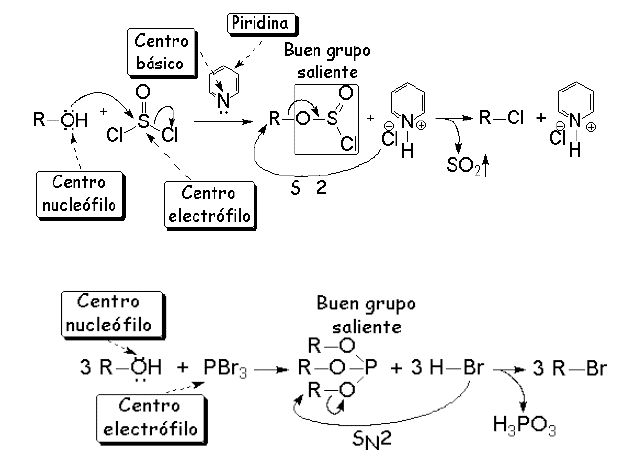
Las reacciones de sustitución nucleofílica de los alcoholes están limitadas porque el -OH es un mal grupo saliente. Para que se produzca este tipo de reacciones es necesario convertir el grupo -OH en un buen grupo saliente empleando un medio ácido o reactivos específicos como el cloruro de tosilo. Otra alternativa es usar nucleófilos como el PBr3 o SOCl2.

El mecanismo de este proceso SN2 es el siguiente: