SUSTITUCIÓN RADICALARIA EN ALCANOS
Una de las pocas reacciones características de los alcanos, además de la combustión, es la de sustitución por medio de halógenos (halogenación). Este es un proceso que transcurre mediante radicales.
Ejemplos de este proceso de halogenación de alcanos son los siguientes:

CARACTERÍSTICAS DE LA HALOGENACIÓN DE ALCANOS

En la práctica, la halogenación de alcanos solo se realiza con cloro o con bromo. El flúor y el iodo no suelen utilizarse. El primero por producir reacciones violentas y el el segundo por producir reacciones demasiado lentas.

El bromo presenta evidentes ventajas, sobre todo su alta selectividad.

Normalmente los halógenos no se utilizan directamente. En su lugar se emplean sustancias que liberan radicales de halógenos. Las más utilizadas son las siguientes:

Como iniciadores también son usados promotores de radicales libres como el peróxido de benzoilo que rebajan la energía de activación de la etapa de iniciación.

El uso de bromo sobre alquenos puede conducir a productos diferentes dependiendo de las condiciones de reacción:
Este tipo de problemas se soluciona con el uso de N-bromosuccinimida
En este caso solo se produce la reacción de sustitución
CLORACIÓN DEL METANO
MECANISMO GENERAL DE LAS REACCIONES RADICALARIAS
Las reacciones radicalarias tienen tres etapas: INICIACIÓN, PROPAGACIÓN y TERMINACIÓN.
Primera etapa: INICIACIÓN

Segunda etapa: PROPAGACIÓN

Tercera etapa: TERMINACIÓN
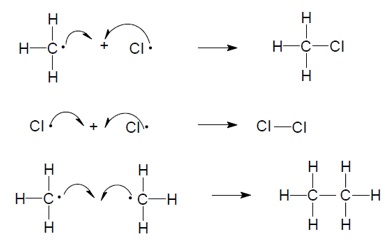
En la etapa de iniciación se forman los radicales de halógeno mediante el uso de luz ultravioleta y calor, o bien mediante el uso de inciadores como el peróxido de benzoilo. Una vez que existen radicales de halógeno en el medio, se produce la etapa de propagación a través de una cadena de dos reacciones que en una primera fase forma radicales del alcano y haluro de hidrógeno y, en una segunda fase, convierte los radicales del alcano en haluros de alquilo y forma nuevos radicales de halógeno que continúan el proceso. Esta etapa de propagación continuará miestras haya reactivos y no se eliminen radicales del medio. La etapa de terminación hace precisamente eso, quitar radicales del medio de diversas formas.
El proceso de halogenación es la consecuencia, por tanto, de dos procesos elementales consecutivos con sus respectivos estados de transición (máximos locales de energía). Entre ellos se encuentra el valle correspondiente al intermedio de reacción que, en este caso, es el radical alquilo. En consecuencia, el perfil energético es el siguiente:

En este caso concreto (cloración del metano) el proceso es exotérmico, con una entalpía de reacción en condiciones estándar de - 25 kcal/mol. El primer proceso elemental, la formación del radical alquilo es el paso controlante de la velocidad porque su energía de activación es mayor que la del segundo paso, la formación del haluro de alquilo (4 kcal/mol frente a 1 kcal/mol).
Cada uno de los pasos elementales de esta reacción es una reacción concertada. En el paso controlante, el ataque del radical halógeno a un hidrógeno del alcano inicia la formación de un enlace H-X. Al mismo tiempo que se forma ese enlace, se rompe homolíticamente el enlace C-H dando como resultado la formación del radical alquilo.

CLORACIÓN DE HIDRÓGENOS SECUNDARIOS Y TERCIARIOS
En la cloración del metano, todos los hidrógenos del alcano eran idénticos. Esa situación también se da en el etano, sin embargo, en alcanos superiores la situación se complica porque, además de hidrógenos primarios, aparecen hidrógenos secundarios y terciarios. Esto, como veremos tiene mucha importancia en la halogenación, ya que la sustitución se produce con preferencia en los hidrógenos que se encuentran en carbonos más sustituidos.
CLORACIÓN DEL PROPANO

En la halogenación del propano se forman dos productos según se sustituya un hidrógeno primario (de los seis que tiene el propano) o un hidrógeno secundario (de los dos que tiene el propano). Experimentalmente se comprueba que el producto mayoritario procede de la sustitución del hidrógeno secundario, a pesar de que estadísticamente es la situación más desfavorable. Teniendo en cuenta que el 57 % de producto es consecuencia de 2 H secundarios y que el 43 % de producto es consecuencia de 6 H primarios, podemos calcular que (57/2)/(43/6) = 4. O sea, es cuatro veces más probable que se produzca la cloración en un hidrógeno secundario que en uno primario. ¿Por qué?.

En el paso controlante de la velocidad se forman dos radicales alquilo diferentes, uno primario y otro secundario. El producto mayoritario procede del radical secundario y el minoritario del primario, luego la distribución de productos depende de la formación asimétrica de los radicales primario y secundario. ¿Por qué se forma más proporción de radicales secundarios que de primarios?.
La razón es simple, el radical secundario es más estable que el primario.

El ataque del radical cloro al H secundario tiene una energía de activación menor (1 kcal/mol) que si se produce sobre el H primario, por ello, el proceso de formación del del radical secundario es más rápido que el del primario. Además, al final del proceso, se forma un radical seundario que es 3 kcal/mol más estable que el primario. En consecuencia, vemos que la formación del radical secundario está favorecida cinética y termodinámicamente. Eso explica la distribución asimétrica de productos.
CLORACIÓN DEL METILPROPANO

Como era de esperar de su composición, en la cloración del metilpropano se forman dos productos monoclorados. El minoritario (36 %) se produce por la sustitución de su único H terciario y el mayoritario (64 %) procede la sustitución de cualquiera de los nueve H primarios que posee. Esto nos permite concluir que (36/1)/(64/9) = 5,1 ,es decir, la sustitución de un H terciario es más de 5 veces más problabe que la de H primario.
La razón es la misma que antes, el radical terciario es mucho más estable que el primario.

En el paso controlante de la cloración del metilpropano se forman dos radicales diferentes, uno primario y otro terciario. La formación de este último está favorecida tanto cinética como termodinámicamente, por eso, es cinco veces más probable que la sustitución se produzca en un H terciario que en uno primario.

BROMACIÓN DEL PROPANO
SELECTIVIDAD FRENTE A REACTIVIDAD
La bromación del propano tiene las mismas etapas que la cloración:
Sin embargo, la distribución de productos es muy diferente

En comparación con la cloración, la bromación del propano es una reacción mucho más selectiva. Si tenemos en cuenta que hay seis H primarios y dos H secundarios, se cumple que: (96,4/2)/(3,6/6) = 80. Es decir, en el caso de la bromación, los H secundarios son preferidos con respecto a los primarios en una proporción de 80 a 1. Esa asimetría es mucho más grande que en el caso de la cloración. La Bromación, por tanto, es mucho más selectiva que la cloración. En el caso de los H terciarios, la proporción de sustitución con respecto a los primarios es de 1700 a 1. En este caso se puede afirmar que la inclusión de átomos de bromo en la moléculas de alcanos es casi completamente selectiva. ¿Por qué? ¿Por qué la bromación es más selectiva que la cloración si en ambos procesos se forman los mismos radicales alquilo?.
Para explicar esta aparente contradicción hay que tener en cuenta que la bromación del propano es un proceso endotérmico y, en consecuencia, teniendo en cuenta el Postulado de Hammond, el estado de transición está más próximo en energía y estructura a los productos (los radicales) que a los reactivos (las moléculas de alcano).

En ambos casos, cloración y bromación, la formación del radical se inicia en la molécula de propano y termina en los dos radicales (uno primario y otro secundario) separados por 3 kcal/mol de diferencia. Sin embargo, en la cloración, proceso exotérmico, el estado de transición está más próximo a los reactivos, por tanto, la diferencia entre los caminos que conducen a los radicales a la altura del estado de transición todavía es pequeña (los dos estados de transción se parecen más al reactivo que al producto) y alcanza solo 1 kcal/mol. En la bromación, proceso endotérmico, el estado de transición de la formación de los radicales se alcanza en las proximidades de los productos (los radicales), por tanto, la diferencia de energía entre ambos estados de transición es mayor que en la cloración, pasando de 1 kca/mol a 2,5 kcal/mol. Al existir una mayor diferencia de energía entre los estados de transición, la velocidad de formación en favor de uno de ellos (el de menor energía de activación) es mayor, consiguiéndose una desproporción mayor en la formación de los radicales y, por consiguiente, de productos.
Esta ganancia de selectividad que se produce en la bromación viene acompañada de una disminución en la reactividad. Selectividad y reactividad son dos propiedades en conflicto en el caso de la halogenación de alcanos.
ANÁLISIS ENERGÉTICO DE LA FORMACIÓN DE RADICALES
La abstracción de hidrógeno por parte del radical halógeno es el paso controlante de la velocidad del proceso. Una vez formado el radical, el posterior enlace con un átomo de halógeno en la segunda etapa es un proceso rápido. Por tanto, la preferencia de la sustitución por unos radicales a otros se puede justificar por el análisis de esa primera fase de la etapa de propagación.
R3CH + X· → R3C· + H-X
Por tanto, las diferencias en la reactividad solo pueden atribuirse a diferencias en la energía de disociación del enlace C-H. Estos valores de la BDE son los siguientes:

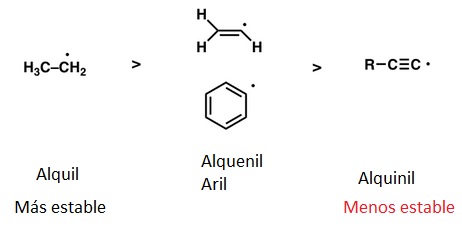
Como puede comprobarse, entre los radicales de alcanos saturados, la menor BDE la tiene el C terciario, luego el C secundario, luego el C primario y, por último el C metílico. Esto se corresponde con lo que hemos estado discutiendo previamente en relación con la formación de radicales. La novedad estriba en los siguientes aspectos:
- Los radicales bencilo y alilo se forman con especial facilidad a causa de su estabilización por efecto resonante. Cabe esperar que los H unidos a C bencílicos o alílicos se pierdan con preferencia. Eso lo demuestra la facilidad de cloración o bromación del tolueno o del etilbenceno (en posición bencílica).
C6H55CH2CH3 + Cl2→ C6H5CHClCH3 + HCl

- Los radicales fenilo y vinilo son especialmente difíciles de producir. La abstracción de hidrógenos unidos a C implicados en dobles enlaces es notoriamente difícil.
La estabilidad de los radicales disminuye a medida que el electrón solitario se encuentra en un orbital que tiene mayor carácter s (y menor p) ya que eso hace que se encuentre más próximo al núcleo.
PRINCIPIOS APLICABLES A LA HALOGENACIÓN DE ALCANOS
- Cuando hay más un tipo de hidrógenos en una molécula, el átomo de hidrógeno sustituido con preferencia será aquel que produzca el radical más estable
- En general, los átomos de carbono sp y sp2 nunca perderán sus hidrógenos. Los hidrógenos sustituidos estará unidos a átomos de carbono sp3
- Entre los átomos de hidrógeno unidos a carbono sp3 el orden de sustitución será el siguiente:
1.- Los que estén unidos a átomos de carbono vecinos de heteroátomos (O, N, ..)
2.- Los que den lugar a radicales bencílicos y alílicos
3.- Los que den lugar a radicales terciarios, secundarios y primarios por este orden.
Ordene los hidrógenos de la siguiente molécula de acuerdo con un facilidad para ser sustituidos en un proceso de halogenación

SUSTITUCIÓN EN CICLOALCANOS
Los cicloalcanos tienen las mismas reacciones de sustitución que los alcanos lineales salvo en el caso de las moléculas más pequeñas. Por ejemplo, en presencia de luz la cloración o bromación del ciclopropano da lugar a dos procesos diferentes: sustitución y adición. Para que se produzca adición, el anillo de ciclopropano se rompe y la cadena de tres carbonos termina uniéndose a dos átomos de halógeno en los extremos. En la oscuridad, el ciclopropano no da reacciones de sustitución pero sí de adición con apertura de anillo.

SUSTITUCIÓN EN ALQUILBENCENOS
La sustitución radicalaria no se produce en los aromáticos, pero sí en las cadenas alquilo que están unidas a anillos de benceno, en particular, en la posición bencílica. Los hidrógenos que están unidos a carbonos vecinos de un anillo bencénico son especialmente reactivos, tanto para la sustitución como para la oxidación.
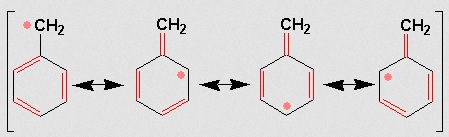
El radical bencilo se puede formar por el ataque de un radical al tolueno.

Este radical se estabiliza por resonancia

Su estabilidad explica que en presencia de halógenos de lugar con facilidad a derivados halogenados.

Otro ejemplo sería el siguiente:





