SUSTITUCIÓN ELECTROFÍLICA EN DERIVADOS DEL BENCENO
En la sustitución electrofílica de derivados del benceno nos aparecen dos problemas que no se planteaban en el caso del benceno. La naturaleza del grupo unido al anillo bencénico afecta de dos maneras diferentes:
- REACTIVIDAD
Hay dos tipos de grupos: ACTIVANTES y DESACTIVANTES. Si el anillo bencénico está unido a un grupo activante, la sustitución aromática electrofílica ocurrirá más rápida que en el benceno. Por el contrario, si el anillo bencénico está unido a un grupo desactivante, la SAE ocurrirá más lenta que en el benceno.
- REGIOQUÍMICA
Todos los hidrógenos del benceno son idénticos con respecto a la SAE. Todos ellos pueden ser sustituidos con la misma probabilida, sin embargo, eso no ocurre en los derivados del benceno. Dependiendo de la posición que ocupe un hidrógeno con respecto al grupo unido al anillo de benceno, su probabilidad de ser sustutido puede ser mayor o menor. Hay grupos (por ejemplo -NH2) que orientan la SAE hacia posiciones orto y para, y hay otros grupos (por ejemplo -COOH) que la orientan hacia la posición meta. En definitiva, nos encontramos que hay dos grandes tipos de grupos: orientadores a orto-para y orientadores a meta.

Los dos problemas: reactividad y regioquímica están relacionados. En general, salvo los halógenos, los grupos ACTIVANTES son ORIENTADORES a ORTO-PARA y los grupos DESACTIVANTES son ORIENTADORES a META. Los halógenos, son DESACTIVANTES pero ORIENTADORES a ORTO-PARA.


La explicación a ambos problemas está en la tendencia a donar o atraer electrones del grupo unido al anillo de benceno.
Es imporante señalar las diferencias estructurales entre los grupos que son moderada o fuertemente donadores o aceptores de electrones. La estructura típica de un grupo donador de carga es la del -OR. En estos casos, el átomo que se une al anillo es un heteroátomo con más electronegatividad que el C y que, además, tiene pares de electrones no compartidos. En el caso de los grupos atractores de carga como el carbonilo -CHO, el átomo que se une al anillo suele ser uno de carbono que está unido a un heteroátomo (habitualmente O o N) más electronegativo y con pares de electrones no compartidos. En el caso de los grupos que donan carga al anillo, los pares de electrones no compartidos del heteroátomo pueden pasar al anillo. En el caso de los atractores de carga, el heteroátomo tira de la carga del átomo de carbono que está unido al anillo y éste, a su vez, hace lo mismo con el anillo bencénico.
REACTIVIDAD Y NATURALEZA DEL GRUPO UNIDO AL ANILLO DE BENCENO
No olvidemos que la etapa controlante de la velocidad de la sustitución aromática electrofílica es el ataque del anillo bencénico a un electrófilo, es decir, una especie química deficiente electrónicamente. Por tanto, cuanto mayor sea la densidad electrónica del anillo bencénico cabe esperar que mayor será la velocidad con que transcurra el proceso.
Si el anillo está unido a un grupo que cede electrones, la densidad electrónica del benceno será alta y aumentará la velocidad de reacción. Por el contrario, si el anillo está unido a un grupo que retira electrones, la densidad electrónica del benceno disminuirá provocando que la SAE sea más lenta que en el benceno.

La energía de activación del proceso de formación del ion bencenonio es diferente según el tipo de sustituyente unido al anillo de benceno. Si es un grupo que retira electrones, la Ea aumentará y hará la reacción más lenta que en el benceno. Si el grupo cede electrones al anillo, la Ea disminuirá y hará que la reacción sea más rápida.

REGIOQUÍMICA Y NATURALEZA DEL GRUPO UNIDO AL ANILLO DE BENCENO
Dependiendo de la posición del ataque del electrófilo (-o, -m, -p), en el ion bencenonio aparece una carga positiva en el carbono del anillo unido al grupo sustituyente. Si este grupo cede electrones estabilizará esa carga positiva, pero si atrae electrones la desestabilizará.



Como vemos, los ataques en posiciones -orto y -para provocan que el carbono unido al sustituyente posea una carga positiva. Por tanto, si el grupo unido al anillo cede carga eléctrica, el ion bencenonio se estabilizará y la reacción ocurrirá en estas posiciones. Sin embargo, si el grupo unido al anillo retira carga eléctrica, el ion bencenonio resultado de este ataque en -o y -p será especialmente inestable y la reacción no ocurrirá en estas posiciones. Como alternativa se producirá la sustitución en -meta, que no genera carga positiva en el carbono unido al grupo sustituyente.

En resumen: Como principio general, los grupos que ceden carga al anillo orientan la SAE en las posiciones -orto y -para. Los grupos que retiran carga la orientan a posición -meta
MECANISMO PARA LA CESIÓN Y ATRACCIÓN DE ELECTRONES
En el movimiento de carga eléctrica entre el grupo sustituyente y el anillo intervienen dos efectos electrónicos: inductivo y resonante.
Mediante efecto resonante y efecto inductivo positivo (+I) se puede producir cesión de electrones al anillo. En cuanto a la intensidad relativa entre ellos se sabe que en elementos del mismo periodo del SP el efecto resonante es más intenso que el inductivo.

De manera similar, por efecto resonante y por efecto inductivo negativo (-I), se puede retirar carga del anillo bencénico.

GRUPOS ACTIVANTES ORIENTADORES A ORTO Y PARA
NITRACIÓN DEL ANISOL
El grupo -OR es activante y director a -orto y -para. En este caso la orientación de la SAE se debe a que en los ataques del electrófilo en posiciones -orto y -para, el ion bencenonio formado resulta especialmente estable ya que su carga positiva está especialmente deslocalizada al aparecer una cuarta forma resonante como resultado de la cesión de electrones del O del grupo OCH3 al carbono con carga positiva del anillo. Esta forma resonante no se forma durante el ataque electrofílico en posición meta.
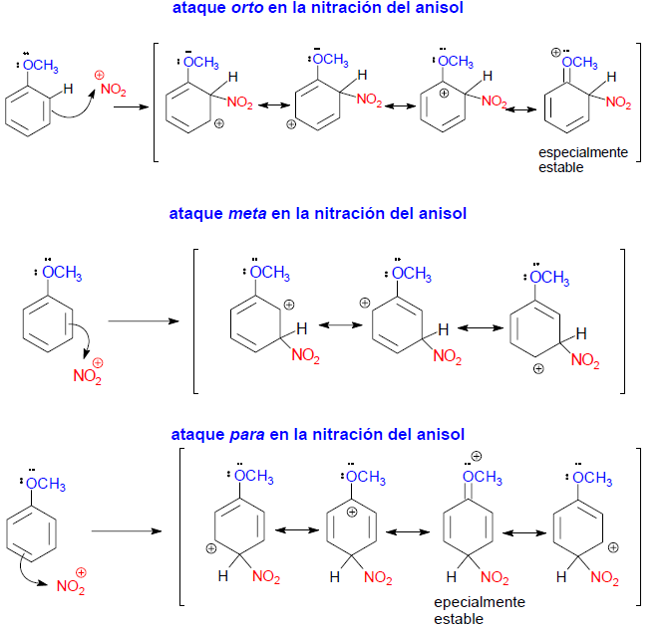
El resultado es que los productos de la nitración en posiciones orto y para están favorecidos

BROMACIÓN DE LA ANILINA
Lo mismo podríamos decir en la bromación de la anilina. El grupo amino -NH2 es activante y director a -orto y -para. Las razones son las mismas que en el ejemplo anterior. En el ataque en posiciones -o y -p el ion bencenonio tiene una estabilización adicional a causa de la cesión de electrones por efecto resonante por parte del grupo sustituyente.
NITRACIÓN DEL TOLUENO
En la nitración del tolueno (y, en general, de los alquilbencenos) también se aprecia orientación a orto y para, sin embargo, en este caso, la estabilización del ion bencenonio formado en los ataques a esas posiciones se produce por efecto inductivo +I del grupo alquilo y no por efecto resonante.

En la bromación del tolueno la distribución entre los isómeros producidos es la siguiente:

GRUPOS DESACTIVANTES ORIENTADORES A META
SUSTITUCIÓN ELECTROFÍLICA EN EL NITROBENCENO
La entrada del electrófilo en posiciones orto y para con respecto al grupo nitro, da lugar a la formación de un ion bencenonio especialmente inestable ya que el nitrógeno cargado positivamente del grupo nitro se encuentra unido a un carbono del anillo con carga positiva. Eso no ocurre en el ataque electrofílico en posición meta. En este caso no hay una forma resonante especialmente inestable entre las tres que se forman.

Como resultado de ello, la nitración del nitrobenceno es más 100000 veces más lenta que la del benceno y la favorece la producción del isómero meta.

SUSTITUCIÓN ELECTROFÍLICA EN LA ACETOFENONA
Al igual que en el nitrobenceno, el ataque en posiciones orto y para de la acetofenona da lugar a la producción de iones bencenonio especialmente inestables. Por esa razón, el producto mayoritario es el obtenido por sustitución en posición meta.

GRUPOS DESACTIVANTES ORIENTADORES A ORTO Y PARA
Este es el caso de los halógenos. En ellos el efecto inductivo -I es más potente que el resonante y ambos se producen en sentidos contrarios. Por una parte, gracias al efecto resonante pueden ceder carga al anillo orientando la sustitución a orto y para pero, por otra parte, por efecto inductivo retiran carga eléctrica. Como el efecto inductivo es más potente que el resonante, el resultado global es una desactivación del anillo que provoca que el proceso sea más lento que en el benceno.
NITRACIÓN DEL CLOROBENCENO

Cuando la sustitución se produce en orto y para, gracias al efecto resonante el ion bencenonio se estabiliza con una forma resonante adicional. Como resultado, la distribución de isómeros es la siguiente:

EFECTOS ESTÉRICOS

La alquilación del t-butilbenceno con cloruro de t-butilo sólo produce el isómero para. No se obtiene el isómero orto como cabría esperar. Eso es consecuencia del gran volumen del grupo t-butilo que impide que el carbocatión atacante pueda acceder a las posiciones orto adyacentes a él. Esto sugiere que el impedimento estérico es una variable importante a considerar en este tipo de reacciones.
ORIENTACIÓN EN BENCENOS DISUSTITUIDOS
Los principios planteados para la orientación y la reactividad de los sustituyentes aplicados en bencenos monosustituidos también son válidos para los bencenos disustituidos. En cuanto a la orientación habrá que tener en cuenta posibles contradicciones y, en cuanto a la reactividad, los efectos de los dos sustituyentes son aditivos.
Si están presentes un grupo activante y uno desactivante, lo normal es que la orientación esté controlada por el grupo activante. Por ejemplo, en el caso del el 4-nitrometilbenceno sería esperable menor reactividad que en el metilbenceno debido al efecto desactivador de un grupo nitro. Además, la posición más probable de sustitución debe ser, y es, orto al grupo metilo y meta al grupo nitro. En este caso, ambos grupos orientaban a la misma posición.
Si entre dos grupos activantes hay conflicto en las orientaciones, en general se cumplirá que el activante más fuerte ganará la partida. En el siguiente caso, las orientaciones del grupo alquilo y el -OH están en conflicto. Al ser un activante fuerte el grupo -OH y un activante débil el -CH3, el grupo nitro entra en orto con respecto al -OH.

En el siguiente caso compiten dos grupos activantes orientadores a orto y para. Como el grupo metoxi es un activante más fuerte que el metilo, la orientación se producirá en orto y para con respecto al grupo metoxi

Si existen dos sustituyentes desactivantes, independientemente de su disposición, la tercera sustitución es prácticamente imposible.
Si dos grupos están en posición relativa meta, la tercera sustitución no entrará entre ellos por dificultades estéricas.

A continuación se muestran algunos ejemplos:

¿En qué posición se producirá la bromación en los siguientes casos?

SUSTITUCIÓN EN HIDROCARBUROS AROMÁTICOS POLINUCLEARES
El naftaleno, fenantreno y antraceno son más reactivos que el benceno en las reacciones de adición y sustitución. Entre otras razones hay que buscar la explicación en que los enlaces en estos aromáticos polinucleares no son todos iguales a los que muestra el benceno. Por ejemplo, el enlace 1-2 del naftaleno es el más corto de todos los que muestra la molécula.

La orientación en la sustitución del naftaleno es compleja, pero la posición 1 parece ser la más reactiva.

Pequeños cambios en la condiciones de reacción o en los reactivos provocan cambios en la sustitución. Por ejemplo, la orientación de la sulfonación cambia con la temperatura.
La sustitución en posición 1 es más favorable que en la 2 porque el ion intermedio de reacción es más estable en ese caso. Contiene más formas resonantes aromáticas .

APLICACIÓN PARA LA SÍNTESIS DE DERIVADOS DEL BENCENO
Los bencenos polisustituídos han de ser creados mediante una secuencia de sustituciones electrófilas cuidadosamente planeadas. Para conseguirlo hay que tener en cuenta una serie de hechos:
1.- Los grupos funcionales pueden convertirse unos en otros, cambiando con ello las características de orientación de la sustitución.
El grupo nitro se puede reducir hasta grupo amino, pasando de ser desactivante orientador -meta a ser activante y orientador a -orto y -para.
Un grupo cetona, desactivante y orientador -meta, puede ser reducido hasta una cadena carbonada, activante y orientador a -orto y -para.
2.- La sulfonación es un proceso reversible.
3.- El grupo amino se puede convertir en una sal de diazonio
4.- El grupo amino se puede convertir en amido para su protección con un haluro de ácido
5.- Una cadena lateral puede ser oxidada en la posición bencílica hasta un grupo carboxílico con permanganato en medio básico en caliente.
6.- La acilación se produce sin transposiciones
¿Cómo se puede obtener el propilbenceno?
EJEMPLOS:
¿Cómo se puede obtener el 1,4-dinitrobenceno?
Hay que tener en cuenta que dos nitraciones sucesivas producirían el isómero 1,3.
¿Cómo se puede sintetizar el 3-iodotertbutilbenceno?
Hay que tener en cuenta que tanto el halógeno como el grupo alquilo orientan a -o y -p
¿Cómo se puede obtener el dodecilbenceno sulfonato de sodio, principio activo de la mayor parte de detergentes que se comercializan?

¿Cómo se puede obtener el 4-nitrotolueno?

Si primero se hiciera la nitración, además de desactivar el anillo y hacer el proceso más lento, el grupo alquilo entraría en posición meta, obteniéndose el isómero 1,3.
¿Cómo se puede obtener el ácido 3-nitrobenzoico?

¿Qué ventajas encuentra a la ruta anterior con respecto a la propuesta a continuación?. Recuerde que las reacciones de Friedel-Crafts (alquilación y acilación) dan muy bajos rendimientos si el anillo bencénico tiene unido algún grupo desactivante o algún grupo -NH2 ; -NHR o NR2.

¿Cómo se puede obtener el 3-bromoetilbenceno?
¿Cómo introduciría un bromo en posición -para de la anilina?

El grupo amino se protege convirtiéndolo en grupo amido. El impedimento estérico del grupo amido, provoca que la bromación sólo se produzca en posición para. Por último se recupera el grupo amino con la hidrólisis de la amida.
Si se intentara la bromación directa de la anilina, el carácter activante fuerte del grupo amino provocaría una mezcla de isómeros.
¿Cómo se puede obtener la 2-nitroanilina?
El problema es la producción de mezcla de isómeros -o y -p , además de la polisustitución a causa del carácter activante fuerte del grupo amino.










