|
||
ÁCIDOS Y BASES PROPIEDADES |
||
INDICE- Indicadores. Valoración ácido-base |
||
PAPEL INDICADOR CASEROPodemos fabricar papel indicador de pH con recursos que podemos tener en casa.Necesitamos el agua utilizada en la cocción de una col lombarda (de color violeta). Sumergimos láminas de papel para que se impregnen bien del colorante. |
||
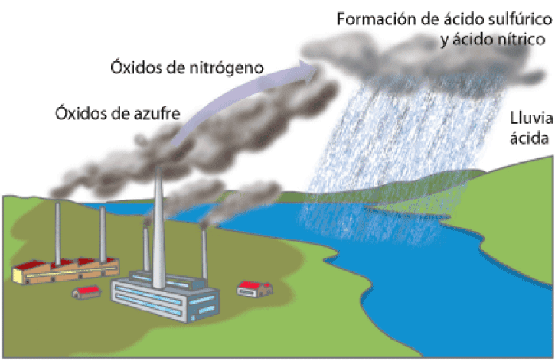
LLUVIA ÁCIDA
La lluvia ácida se produce cuando llueve en un lugar en el que la atmósfera contiene elevadas cantidades de óxidos de nitrógeno o azufre. Estos óxidos reaccionan con el agua y forman ácidos que llegan al suelo con las gotas de agua. El efecto sobre la vegetación es letal, ya que los ácidos son corrosivos. El efecto sobre las estructuras hechas de caliza (CaCO3) también es muy negativo ya que esta sustancia se disuelve en medio ácido.
|
||
LA DESTRUCCIÓN DE LOS CORALESLos ácidos no tienen que ser especialmente fuertes para producir grandes destrozos en la naturaleza. Lo hemos visto con la lluvia ácida. Otro ejemplo del efecto pernicioso que pueden tener estas sustancias en el medio ambiente es la destrucción de los corales a causa del aumento del dióxido de carbono en la atmósfera.La combustión de combustibles fósiles ha elevado la concentración de CO2 en la atmósfera terrestre. Hasta comienzos del siglo XX se mantuvo por debajo de 300 ppm, sin embargo, desde entonces ha aumentado hasta alcanzar casi las 400 ppm. Este hecho tiene graves efectos en la vida marina y, en particular en los corales.
Las disoluciones acuosas de dióxido de carbono son débilmente ácidas.La reacción entre este gas y el agua produce ácido carbónico que se disocia produciendo iones bicarbonato e iones hidrógeno. Este hecho tiene graves consecuencias en la vida de los corales.El coral vive en colonias que no son otra cosa que grandes estructuras construidas a base de carbonato de calcio. Aunque esta sustancia es poco soluble, una pequeña fracción de ella se disuelve estableciéndose un equilibrio entre el sólido y los iones en disolución (carbonato y calcio). A lo largo de la historia los corales han conseguido mantener sus colonias en un ambiente marino en el que la acidez del agua ha sido más o menos constante a lo largo del tiempo.CaCO3 (s) = CO3= (aq) + Ca++ (aq) El problema ha surgido con el aumento repentino de la concentración de dióxido de carbono en el aire en el último siglo. Eso ha provocado que aumente rápidamente su solubilidad en el agua marina y, como consecuencia, que aumente la cantidad de ácido carbónico en ella. La acidez de los mares ha aumentado, es decir, la concentración de iones hidrógeno ha crecido.CO2 (g) + H2O (l) = H2CO3 (aq) = HCO3- (aq) + H+(aq) El gran problema se produce cuando los iones hidroxilo procedentes de la hidrólisis de los iones carbonato se unen con los iones hidrógeno para formar aguaCO3= (aq) + H2O (l) = HCO3- (aq) + OH-(aq) H+(aq) + OH-(aq) = H2O (l) Es evidente que cuanto mayor sea la cantidad de iones hidrógeno en el agua de mar mayor será también la cantidad de iones hidroxilo que reaccionarán con ellos. Eso provoca que la hidrólisis de los iones carbonato se producirá en mayor extensión y, en último término, la solubilización del carbonato de calcio.En otras palabras, el aumento de la acidez del agua de mar desplaza el equilibrio de solubilidad del carbonato de calcio hacia la derecha, es decir, hacia la solubilización de la colonia de coral.
|
||
EL BLANQUEADO DE LA ROPAHasta hace 200 años, el blanqueo de las telas era cuestión de sol y de reacciones químicas con ácidos (obtenidos de la leche o ácido sulfúrico) o con bases (lejías a base de hidróxido de sodio o de potasio obtenidas de la ceniza de madera vegetal).Desde la antigüedad el ser humano ha tejido tela de diversas fibras vegetales (algodón, lino, ..) y animales (seda, lana, ..). El resultado era un tejido de color más o menos marrón que siempre estaba de moda. El uso de pigmentos para colorear la tela era difícil y costoso y sólo estaba al alcance de un sector social privilegiado. Lo mismo podría decirse de la tela blanca. ¿Cómo se podía blanquear la tela quitándole ese desagradable color a "sucio"?.Se sabe que los antiguos egipcios (hace 3000 años) ya blanqueaban la ropa usando lejía obtenida de cenizas vegetales. Este es un recurso lento que se ha usado hasta hace poco tiempo. En Europa hay un país que se especializó en el blanqueo de la ropa: Holanda (Países Bajos). A partir de los siglos XI y XII en la zona de Flandes se recibía mucha de la tela que se producía en el resto de Europa para proceder a su blanqueo. Los artesanos holandeses habían desarrollado un método que utilizaba una primera fase de tratamiento con lejía (básico) seguido por otro a base de leche agria (ácido). La combinación de ambos procesos con largos periodos al sol (campos de blanqueo), convertía el lino marrón en una tela blanca de gran demanda en todo el mundo. El método, cuyos secretos fueron guardos con celo por los holandeses, sólo tenía un problema: tardaba ocho meses en completarse. |