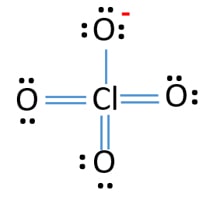
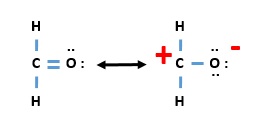
ESTRUCTURAS DE LEWIS
Las estruturas de Lewis son representaciones de las especies químicas que indican los enlaces que unen los átomos y los pares de electrones no compartidos que poseen.
Para construirlas se utilizan los símbolos de Lewis

Ejemplos
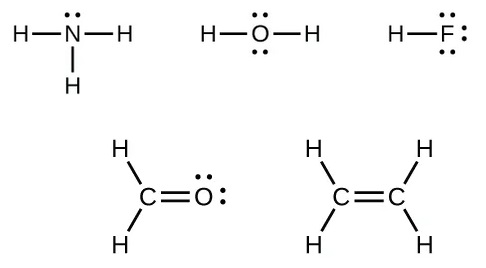
Las líneas indican un par de electrones de enlace. Cada punto es un electrón no compartido.
De acuerdo con estas estructuras:
Amoniaco: En su molécula hay tres enlaces covalentes simples que unen el átomo de nitrógeno con los tres átomos de hidrógeno, además, el átomo de nitrógeno tiene un par de electrones no compartido.
Agua: En su molécula hay dos enlaces covalentes simples y el átomo de oxígeno tiene dos pares de electrones no compartidos
Fluoruro de hidrógeno: En su molécula hay un enlace simple y el átomo de flúor tiene tres pares de electrones no compartidos
Formaldehido: El átomo de carbono es el centro de la molécula y está enlazado por enlaces simples a los átomos de hidrógeno y por enlace doble al átomo de oxígeno (éste posee dos pares de electrones no compartidos)
Eteno: Cada átomo de carbono está unido por enlaces simples a los átomos de hidrógeno y por enlace doble al otro átomo de carbono
Una cuestión: ¿Por qué la molécula de agua no puede tener la fórmula H3O?
OJO: LAS ESTRUCTURAS DE LEWIS NO INDICAN LA FORMA DE LAS MOLÉCULAS. ESE PROBLEMA LO RESOLVEREMOS APLICANDO EL MÉTODO DE REPULSIÓN DE PARES DE ELECTRONES DE LA CAPA DE VALENCIA.
PROCEDIMIENTO ESTÁNDAR PARA DETERMINAR ESTRUCTURAS DE LEWIS
1.- Calcular el número de electrones en las capas de valencia de los átomos que forman la especie química.
EJEMPLO: MOLÉCULA AGUA (H2O)
1.- nºecv = 6 + 2x1 = 8 (4 pares)
2.- Construir una estructura de Lewis PRELIMINAR colocando como átomo central el menos electronegativo (No puede ser el H) y, usando pares de electrones, unirlo a los átomos periféricos. Los pares de electrones sobrantes se colocan sobre los átomos periféricos (como pares de electrones no compartidos) para cumplir en ellos la regla del octeto. Si sobran electrones se colocan sobre el átomo central (como pares de electrones no compartidos).
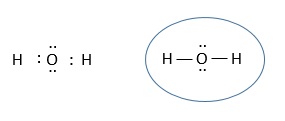
SI LLEGADOS A ESTE PUNTO SE CUMPLE LA REGLA DEL OCTETO EN TODOS LOS ÁTOMOS, HEMOS TERMINADO LA ESTRUCTURA DE LEWIS. EN CASO CONTRARIO, SE CONTINÚA
3.- Colocar enlaces múltiples para conseguir cumplir la regla del octeto en todos los átomos.
4.- Determinar las cargas formales
5.- Valorar la existencia de formas resonantes.
De acuerdo con la estructura de Lewis del agua, en su molécula hay dos enlaces covalentes simples que conectan cada uno de los átomos de hidrógeno con el átomo central de oxígeno. El átomo de oxígeno tiene dos pares de electrones sin compartir
EJEMPLO: MOLÉCULA DE AMONIACO
1.- necv = 5 + 3x1 = 8 (4 pares)
2.-
Todos los átomos cumplen la regla del octeto. Estructura terminada.
3.- No son necesarios enlaces múltiples.
4.- No hay cargas formales
5.- No hay formas resonantes
En la molécula de amoniaco hay dos enlaces covalentes simples que conectan cada uno de los átomos de hidrógeno con el átomo central de nitrógeno. El átomo de nitrógeno tiene un par de electrones sin compartir.
EJEMPLO: MOLÉCULA DE OZONO (O3)
1.- necv = 6 + 6 + 6 = 18 (9 pares)
2.- 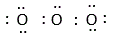
Usamos dos pares de electrones para unir el átomo central con los dos laterales. Seguidamente colocamos tres pares de electrones no compartidos sobre cada átomo lateral para que cumplan la regla del octeto (de esa forma se han utilizado ocho pares de electrones del total de nueve de que disponíamos inicialmente). El último par de electrones se coloca sobre el átomo de oxígeno central (único átomo que puede aceptarlo)
Vemos que el átomo central no cumple la regla del octeto. Hay que plantearse la presencia de enlaces múltiples.
3.- 
Uno de los pares de electrones no compartidos del átomo de la izquierda se ha situado como par electrónico compartido con el átomo central. Se ha formado un enlace doble.
Ahora el átomo central sí cumple la regla del octeto. Los otros dos también.
4.- Ojo: Hay cargas formales. El átomo O de la izquierda no tiene carga formal [6-(4+2)]. El átomo O central tiene carga +1 [6-(2+3)]. El átomo O de la derecha tiene carga -1 [6-(6+1)].
La molécula de ozono es neutra pero en su interior hay átomos con carga
5.- Ojo: Hay formas resonantes. La molécula de ozono tiene dos formas resonantes idénticas
Conclusión: En la molécula de ozono hay dos enlaces covalentes, uno simple y otro doble que cambian continuamente de posición. Es como si cada uno de ellos fuera todo el tiempo un enlace intermedio entre simple y doble. Lo mismo ocurre con las cargas formales. El átomo central siempre tiene una carga formal positiva, pero los átomos de oxígeno laterales se comportan como si siempre tuvieran 1/2 de carga negativa.
Híbrido de resonancia del ozono
Ejemplo: Formaldehido (HCOH)
1.- necv = 6 + 4 + 2 x (1) = 12 (6 pares de electrones)
2.- Estructura preliminar
En las moléculas simples el átomo central es el menos electronegativo (nunca H), por ello, es esperale que sea el C.
Colocamos el C rodeado de los átomos de H y O. Los unimos por enlaces simples (consumimos tres pares de electrones). Los tres pares de electrones restantes los colocamos sobre el oxígeno para que cumpla la regla del octeto.
En la estructura resultante el átomo de C no cumple con la regla del octeto. Hay que pensar en la existencia de enlaces múltiples
3.- Enlaces múltiples
Al convertir un par de electrones no compartidos del O en un par de electrones de enlace entre C y O todos los átomos cumplen la regla del octeto.
4.- Cargas formales
Ningún átomo de esa estructura tiene carga formal:
C: 4 - 0 - 4 = 0
O: 6 - 4 - 2 = 0
5.- Formas resonantes
La existencia de un par de electrones no compartido junto a un doble enlace sugiere la existencia de otra forma resonante en esa molécula.
La existencia de dos formas resonantes en el formaldehido no indica que ambas sean igual de estables y contribuyan al híbrido de resonancia por igual. En este caso la primera es mucho más estable que la segunda. De hecho es esperable que esta última sea muy inestable, no solo tiene cargas formales sino que también tiene un átomo (C) que no cumple la regla del octeto.
EXCEPCIONES A LA REGLA DEL OCTETO
La regla del octeto no siempre se cumple, es importante conocer esta limitación de la Teoría de Lewis.
ESPECIES CON UN NÚMERO IMPAR DE ELECTRONES


ESPECIES CON ÁTOMOS DE BERILIO O BORO (segundo periodo del sistema periódico), QUE FORMAN OCTETOS INCOMPLETOS

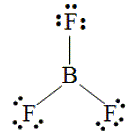
ESPECIES CON ÁTOMOS DE AZUFRE, FÓSFORO O CLORO (tercer periodo del sistema periódico), QUE FORMAN OCTETOS EXPANDIDOS